Français / Español / 简体中文 / русский / العربية / 日本語
© 2024 World Federation of Hemophilia
يلعب الاتحاد العالمي للهيمويليا دورًا مهمًا في تثقيف المجتمعات بشأن عملية التجارب السريرية. ستجد في هذه الصفحة معلومات تتعلق بجميع جوانب التجارب السريرية ، بما في ذلك ما يلي:
تعرف على المراحل المختلفة للتجارب السريرية ، بما في ذلك فترات الدراسة ومعايير الانتقال إلى المرحلة التالية من التجربة.
مراحل التجربة السريرية
اقرأ عن العمليات المختلفة المعمول بها للتأكد من أن سلامة المشاركين تخضع دائمًا للمراقبة.
ضمان سلامة المشاركين
تعرف على المزيد حول الأسئلة المختلفة التي يجب طرحها قبل المشاركة في تجربة سريرية.
المشاركة في تجربة سريرية
انظر ادناه لمعرفة المزيد عن التجارب السريرية.
تشتمل الدراسات السريرية عادةً على متطوعين بشريين أو مشاركين أو عينات (دم أو أنسجة أخرى) من البشر بقصد تطوير المعرفة الطبية. هناك نوعان رئيسيان من الدراسات السريرية: التجارب السريرية (وتسمى أيضًا الدراسات التدخلية) والدراسات القائمة على الملاحظة.
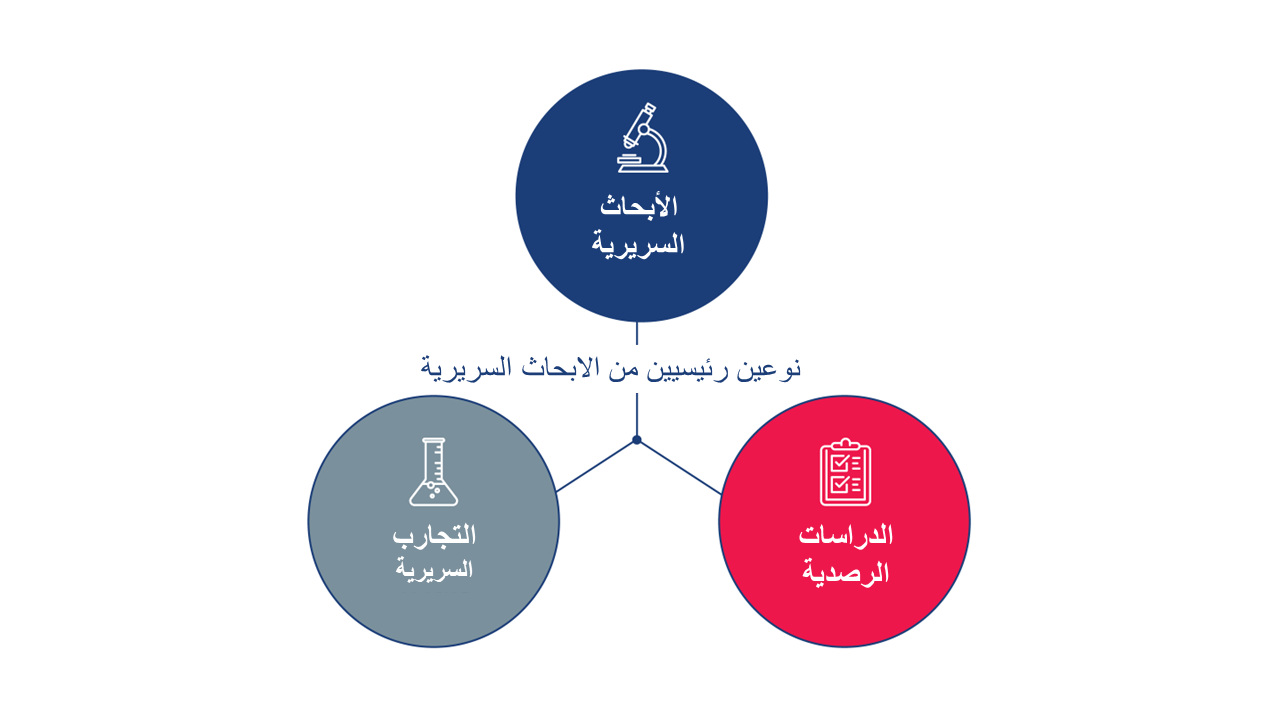
التجربة السريرية هي نوع من الدراسات البحثية التي يختبر فيها الباحثون طرقًا جديدة للوقاية من الأمراض أو اكتشافها أو علاجها. يتلقى المشاركون في إحدى التجارب السريرية مدخلات محددة وفقًا لبروتوكول مفصل لتلك التجربة السريرية. قد تكون هذه المدخلات منتجات طبية، مثل الأدوية أو الأجهزة أو الإجراءات الجراحية أو تغييرات في السلوك، مثل النظام الغذائي للمشارك.
قد تقارن التجارب السريرية طريقة علاج جديدة بالطريقة القياسية المتوفرة بالفعل، أو بالبدائل العلاجية، أو قد تكون بدون تدخلات. التجارب السريرية هي الطريقة الرئيسية التي يستخدمها الباحثون لمعرفة ما إذا كان العلاج الجديد آمنًا وفعالًا. لكي يصبح الدواء دواءً يمكن للأطباء وصفه، يجب أولاً اختباره في سلسلة من التجارب السريرية ، تُعرف باسم المرحلة 1 والمرحلة 2 والمرحلة 3. بعد المرحلة 3 من التجارب السريرية ، يتم إرسال البيانات من التجارب السريرية إلى وكالة تنظيمية تحدد بعد ذلك ما إذا كان ينبغي الموافقة على هذا الدواء للاستخدام.
هناك أنواع مختلفة من التجارب السريرية:
غالبًا ما تستخدم المصطلحات التالية في وصف التجارب السريرية:
هي نوع من الدراسة البحثية حيث يلاحظ الباحثون الآثار العلاجية في مجموعة من المشاركين، دون تدخل من قبل الباحثين. لا يتم تعريض المشاركين لتدخلات محددة من قبل الباحث، كما هو الحال في التجربة الإكلينيكية، ولكن قد يتلقون علاجًا يعد بالفعل جزءًا من رعايتهم الطبية الروتينية. يمكن للباحثين بعد ذلك تقييم الارتباطات بين التدخلات والنتائج الصحية، على الأشخاص الذين يتلقون العلاج كجزء من الرعاية القياسية. قد تؤدي هذه النتائج إلى مزيد من الاختبارات في تجربة سريرية. هناك عدة أنواع مختلفة من الدراسات القائمة على الملاحظة. سجل المرضى هو نوع من الدراسة القائمة على الملاحظة.
سجل المرضى هو نظام منظم يستخدم طرق الدراسة القائمة على الملاحظة لجمع البيانات حول العلاجات والنتائج السريرية ورفاهية الاشخاص المصابين بمرض أو حالة أو أعراض معينة.
بالنسبة لمجتمع الهيموفيليا، هناك سجلين هامين للمرضى هما:
السجل العالمي لاضطرابات النزف (WBDR) هو نظام لإدخال البيانات على شبكة الإنترنت يوفر منصة لشبكة من مراكز علاج الهيموفيليا حول العالم لجمع بيانات موحدة للمرضى، ولتوجيه الممارسة السريرية. بموافقة المريض، يخزن السجل العالمي لاضطرابات النزف البيانات عن مرض الشخص، مثل نوع الهيموفيليا وشدتها والأعراض والعلاج والنتائج الصحية.
يمكن لمتخصصي الرعاية الصحية المشاركين في السجل العالمي لاضطرابات النزف واستخدام السجل العالمي لاضطرابات النزف لتتبع ومراقبة تقدم المريض وتوجيه الرعاية السريرية الخاصة بهم. يمكن أيضًا استخدام هذه البيانات السرية وغير المحددة الهوية لمساعدة الباحثين على الإجابة عن الأسئلة المهمة حول التفاوتات في الرعاية على مستوى العالم والمساعدة في تعزيز مبادرات المناصرة / السياسة الصحية. انقر هنا للحصول على صفحة WBDR
من خلال جهد تعاوني دولي، طور الاتحاد العالمي للهيموفيليا (WFH) سجلاً عالميًا لمرضى العلاج الجيني ، وهو سجل العلاج الجيني (GTR) في الاتحاد العالمي للهيموفيليا. الهدف من سجل العلاج الجيني هو توفير قاعدة بيانات قوية وصالحة علميًا، ومتاحة لجميع مقدمي الرعاية الصحية الذين يعالجون الأشخاص المصابين بالهيموفيليا الذين يتلقون العلاج الجيني ، في أي مكان في العالم. سيتم استخدام البيانات التي تم جمعها من خلال سجل العلاج الجيني لتقييم سلامة وفعالية العلاج الجيني على المدى الطويل للأشخاص المصابين بالهيموفيليا.
انقر هنا للحصول على سجل العلاج الجيني
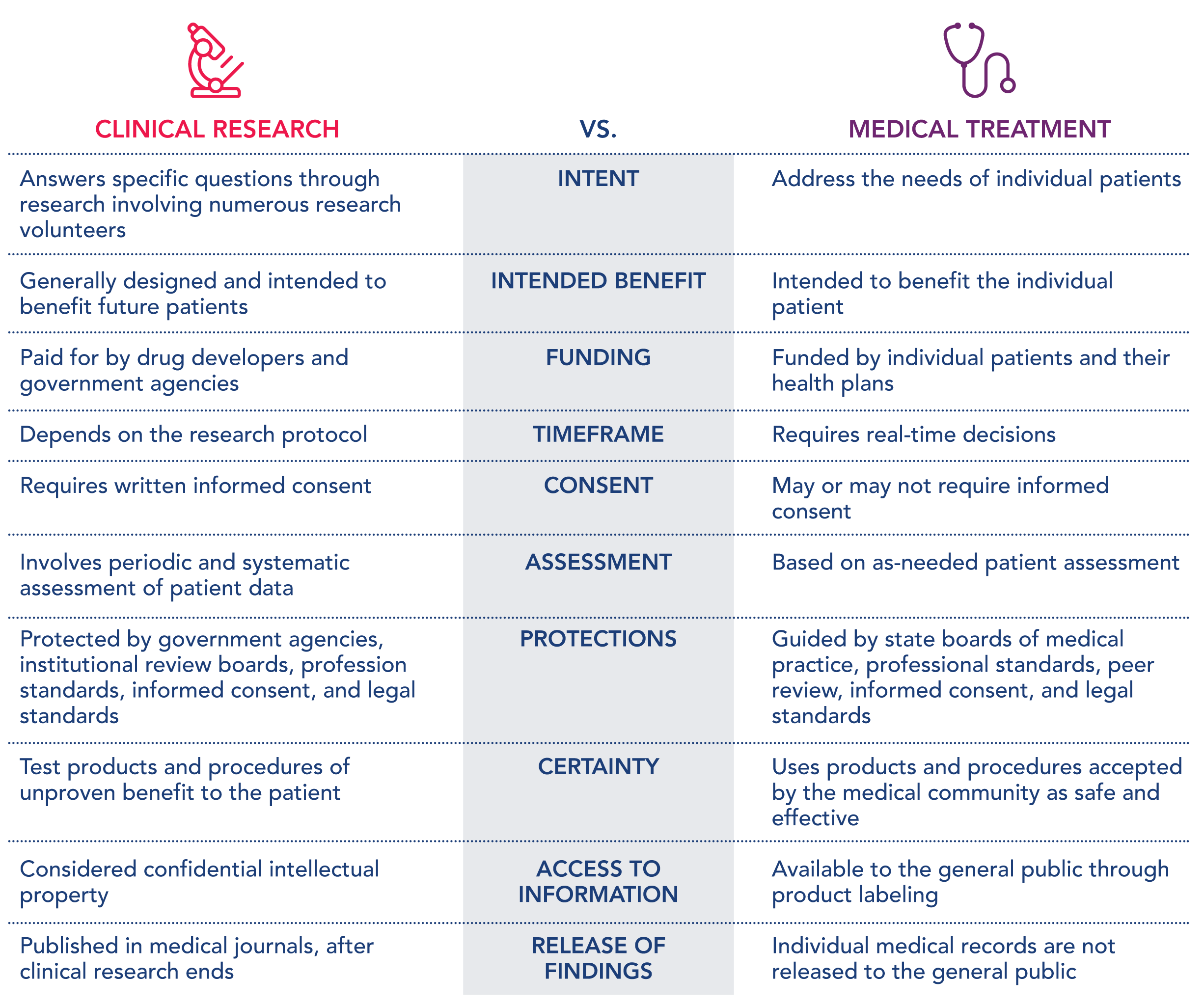
يمكن أن يكون الجدول التالي مفيدًا لمعرفة مدى اختلاف البحث السريري عن العلاج الطبي.
انقر هنا للحصول على مسرد المصطلحات
يتم تصميم التجارب السريرية وإجرائها لإيجاد طرق أفضل لتشخيص الأمراض أو الحالات وعلاجها والوقاية منها.
يجب اختبار التدخل او العلاج في تجربة سريرية للتأكد من أنه آمن وفعال، قبل الموافقة على استخدامه لعلاج المرضى من قبل وكالة تنظيمية (مثل وكالة الأدوية الأوروبية (EMA) أو إدارة الغذاء والدواء الأمريكية (FDA))
بعض الأسباب الشائعة لإجراء التجارب السريرية:
على سبيل المثال ، هناك العديد من التجارب السريرية الجارية ، في مراحل مختلفة من التطوير ، لتقييم مدى أمان وفعالية العلاج الجيني للأشخاص المصابين بالهيموفيليا.
لكي يصبح الدواء علاجًا يمكن للأطباء وصفه ، يجب أولاً اختباره في سلسلة من مراحل التجارب السريرية ، ثم تقييمه والموافقة عليه من قبل وكالة تنظيمية. كل مرحلة من مراحل التجارب السريرية لها هدف، و تتم المراحل بالترتيب من المرحلة 1 إلى المرحلة 4.
المرحلة 1:
هذه هي المرة الأولى التي يتم فيها اختبار علاج استقصائي جديد على الأشخاص. الغرض من التجارب السريرية للمرحلة الأولى هو تقييم السلامة والآثار الجانبية المرتبطة بالعلاج. غالبًا ما يتم تطبيق هذه المرحلة على مجموعة صغيرة من المتطوعين الأصحاء. ومع ذلك ، في الأمراض النادرة ، مثل الهيموفيليا ، تُجرى تجارب المرحلة الأولى عادةً على الأشخاص المصابين بالهيموفيليا. عادةً ما تستغرق التجارب السريرية للمرحلة الأولى عدة أشهر وينتقل ما يقرب من 70٪ من العلاجات التي تم اختبارها في تجارب المرحلة الأولى إلى المرحلة التالية. أما النسبة الباقية و البالغة ا30٪ من العلاجات والتي لم يثبت أنها آمنة في المرحلة الأولى فلا تتقدم إلى ما بعد المرحلة الأولى.
المرحلة الأولى من العلاج الجيني للهيموفيليا تضم التجارب السريرية ما بين 10-30 شخصًا مصابًا بالهيموفيليا.
المرحلة الثانية:
الغرض من المرحلة الثانية من التجارب السريرية هو الاستمرار في اختبار السلامة والآثار الجانبية المرتبطة بالعلاج، وأيضًا اختبار الفعالية وتحديد الجرعات الأكثر فعالية. تُجرى تجارب المرحلة الثانية عادةً على عدد أكبر من المشاركين مقارنةً بتجارب المرحلة الأولى، وتشمل الأشخاص المصابين بالمرض. في بعض الحالات، يتم الجمع بين تجارب المرحلتين 1 و 2 ويشار إليهما بالمرحلة 1/2. تستغرق التجارب السريرية للمرحلة الثانية عادةً عدة أشهر إلى سنتين. تشير التقديرات إلى أن 30٪ من العلاجات التي تم اختبارها في تجارب المرحلة الثانية تنتقل إلى المرحلة التالية. لا يتقدم التطور السريري إلى ما بعد المرحلة الثانية إذا لم يكن العلاج فعالاً أو اذا وجدت مخاوف تتعلق بالسلامة.
المرحلة الثانية من العلاج الجيني بالهيموفيليا تضم التجارب السريرية ما بين 10-50 شخصًا مصابًا بالهيموفيليا. هذا الرقم أقل منه في حالات المرض الأخرى لأن الهيموفيليا مرض نادر. غالبًا ما يتم الجمع بين المرحلتين الأولى والثانية من التجارب السريرية للأمراض النادرة مثل الهيموفيليا. من خلال الجمع بين مراحل التجربة، يأمل مصنعو الأدوية في تسريع الجداول الزمنية لتطوير الأدوية الجديدة.
المرحلة 3:
الغرض من المرحلة 3 من التجارب السريرية هو تأكيد فعالية العلاج ومراقبة الآثار الجانبية ومقارنة العلاج الجديد بالعلاجات القياسية أو العلاجات المماثلة. تُجرى تجارب المرحلة 3 ، التي يطلق عليها أحيانًا “تجربة محورية” ، على عدد كبير من الأشخاص المصابين بالمرض وفي العديد من مواقع الدراسة المختلفة (الوطنية والدولية ، اعتمادًا على الدراسة). تكون التجارب السريرية للمرحلة الثالثة في بعض الأحيان عشوائية وغالبًا ما تكون مزدوجة التعمية. عادةً ما تستغرق التجارب السريرية للمرحلة الثالثة من 1 إلى 4 سنوات وهي الخطوة الأخيرة قبل تقديم طلب إلى وكالة تنظيمية للموافقة على العلاج. ما يقدر بنحو 25٪ من تجارب المرحلة 3 تنتقل إلى دراسات المرحلة 4.
يتم تقديم البيانات المأخوذة من المرحلة الثالثة من الدراسة المحورية، وأحيانًا البيانات من المرحلة الأولى والثانية من التجارب السريرية، إلى الوكالة التنظيمية للمراجعة. تجري الوكالة التنظيمية تحليلات مستقلة حول سلامة وفعالية العلاج وتتخذ قرارًا بشأن ما إذا كان العلاج معتمدًا للاستخدام من قبل المرضى أم لا.
المرحلة 3 من التجارب السريرية للعلاج الجيني بالهيموفيليا تضم ما بين 50-150 شخصًا مصابًا بالهيموفيليا ويتم إجراؤها في مواقع الدراسة حول العالم.
المرحلة 4:
تُجرى المرحلة 4، التي تسمى أحيانًا تجارب ما بعد التسويق ، بعد حصول العلاج الجديد على موافقة الجهات التنظيمية ويكون متاحًا للمرضى. تسمح هذه الدراسات للباحثين بجمع معلومات إضافية حول المخاطر طويلة المدى (بما في ذلك الآثار الجانبية النادرة) وفوائد العلاج، فضلاً عن الاستخدام الأمثل في ظروف “العالم الحقيقي”.
يرجى الاطلاع على لمزيد من المعلومات

لكل تجربة سريرية خطة مفصلة وشاملة لإجراء التجربة تسمى البروتوكول. تم تطوير بروتوكول التجارب السريرية للإجابة على أسئلة بحثية محددة ولحماية صحة المشاركين في الدراسة. تتم مراجعة البروتوكول والموافقة عليه من قبل احدى الوكالات التنظيمية قبل أن تبدأ التجربة السريرية. تتضمن المعلومات الواردة في بروتوكول التجارب السريرية ما يلي:
تذكير: الأهلية تشير إلى المتطلبات الأساسية التي يجب تلبيتها للأشخاص للمشاركة في تجربة سريرية. تشمل الأهلية معايير التضمين (المطلوبة للمشاركة) ومعايير الاستبعاد (التي تمنع الشخص من المشاركة). انظر الأمثلة هنا
نقاط نهاية الدراسة
يحدد برنامج التطوير السريري للعلاج أو التدخل الجديد ما إذا كان العلاج الجديد فعالًا وآمنًا. في بروتوكول التجارب السريرية، تكون نقطة النهاية الأولية هي مقياس النتيجة المخطط له وهو الأكثر أهمية لتقييم التدخل أو العلاج. اعتمادًا على مرحلة التجربة السريرية، قد تركز نقطة النهاية الأولية على السلامة، مثل الأحداث الضارة المتعلقة بالعلاج و / أو التغييرات من خط الأساس في التقييمات المختبرية السريرية؛ أو الفعالية، مثل معدل النزف السنوي أو مستوى العامل.
أمثلة على نقاط نهاية الأمان والفعالية في التجارب السريرية للهيموفيليا (بما في ذلك تجارب العلاج الجيني):
| نقاط نهاية الفعالية | نقاط نهاية السلامة |
|
|
يجب أن تفكر مليًا في قرار المشاركة في تجربة سريرية ومناقشته مع طبيبك وعائلتك. بمساعدة طبيبك، يجب أن تقييم مزايا ومخاطر المشاركة بالإضافة إلى الالتزام بالوقت المطلوب للمشاركة.
من الأهمية بمكان فهم الفوائد والمخاطر المحتملة للمشاركة في تجربة سريرية.
| الفوائد المحتملة | المخاطر المحتملة |
| قد تتمكن من الوصول إلى علاج جديد قبل توفره ويمكن أن تكون من بين أول المستفيدين | قد تواجه آثارًا جانبية غير مرغوب فيها للعلاج الجديد |
| ستحصل على دعم فريق رعاية الهيموفيليا الخبير الذي سيراقب صحتك عن كثب | قد لا يعمل العلاج الجديد من أجلك أو قد تتلقى العلاج الوهمي إذا كانت الدراسة خاضعة للتحكم الوهمي |
| سيكون لديك فرصة للعب دور فعال في تحسين صحتك وتحسين إدارة الهيموفيليا لديك | قد لا يكون العلاج الجديد قيد الدراسة أفضل من مستوى الرعاية الحالي |
| يمكنك مساعدة الأشخاص المستقبليين الذين تم تشخيصهم بالهيموفيليا من خلال المساهمة في تطوير علاج محتمل | قد تستغرق التجربة وقتًا أطول من العلاج المعتاد؛ قد يكون لديك المزيد من زيارات الطبيب والاختبارات |
يحتاج المشاركون المحتملون في التجارب السريرية إلى تذكر أن الغرض من التجربة السريرية هو دراسة علاج أو تدخل جديد.
تتم دعوة المرضى للانضمام إلى التجارب السريرية من خلال فريق الرعاية الصحية الخاص بهم، بناءً على معايير الأهلية للدراسة. تشير الأهلية إلى المتطلبات الأساسية التي يجب أن يستوفيها الأشخاص ليتمكنوا من المشاركة في تجربة سريرية. تساعد هذه المعايير في ضمان سلامة المشاركين والتأكد من أن الأسئلة البحثية المحددة التي تتم دراستها في التجربة السريرية قد يتم الإجابة عليها بدقة.
لكل دراسة معايير للاشتمال ومعايير للاستبعاد.
بالنسبة لتجارب الهيموفيليا السريرية، تعتبر شدة الهيموفيليا ونوعها والعمر وحالة المثبط وتاريخ العلاج الوقائي عوامل شائعة تحدد الأهلية. تعد كل تجربة سريرية فريدة من نوعها فتختلف معايير الأهلية من دراسة إلى أخرى. تبدأ العديد من التجارب السريرية على البالغين أولاً، قبل دراسة تأثير العلاج الجديد على الأطفال. لهذا السبب، من الشائع جدًا رؤية العمر مدرجًا كمعيار للاشتمال.
هل تريد معرفة المزيد عن معايير الأهلية؟
الأشخاص المصابون بالهيموفيليا المهتمون بالمشاركة في تجربة سريرية سيخضعون لـ “عملية فحص” حيث سيحدد فريق البحث ما إذا كان هذا الشخص مستوف لمعايير الأهلية للدراسة. ستشمل عملية الفحص مراجعة التاريخ الطبي للمريض المصاب بالهيموفيليا والحالة الطبية الحالية، بالإضافة إلى مناقشات حول أدوار ومسؤوليات المشاركين، والمخاطر والفوائد المحتملة للمشاركة.
من المهم أن نفهم أنه لن تتاح الفرصة المشاركة في تجربة سريرية لكل المهتمين بالمشاركة. وهذا لأن بعض جوانب التاريخ الطبي للشخص لا تفي بمعايير الاشتمال للتجربة (على سبيل المثال، قد تقوم دراسة بتسجيل مرضى مصابين بالهيموفيليا لعمر معين فقط) علاوة على ذلك ، سيكون لكل تجربة سريرية عدد تقديري من المشاركين للتسجيل المخطط له ، عندما تستوفي التجربة السريرية العدد المطلوب من الأشخاص المسجلين ، سيتوقف قبول مشاركين إضافيين في الدراسة.
مراجعة مثال (أفتراضي) لمعايير الأهلية لتجارب الهيموفيليا السريرية: مثال 1 العلاج الجيني في الهيموفيليا
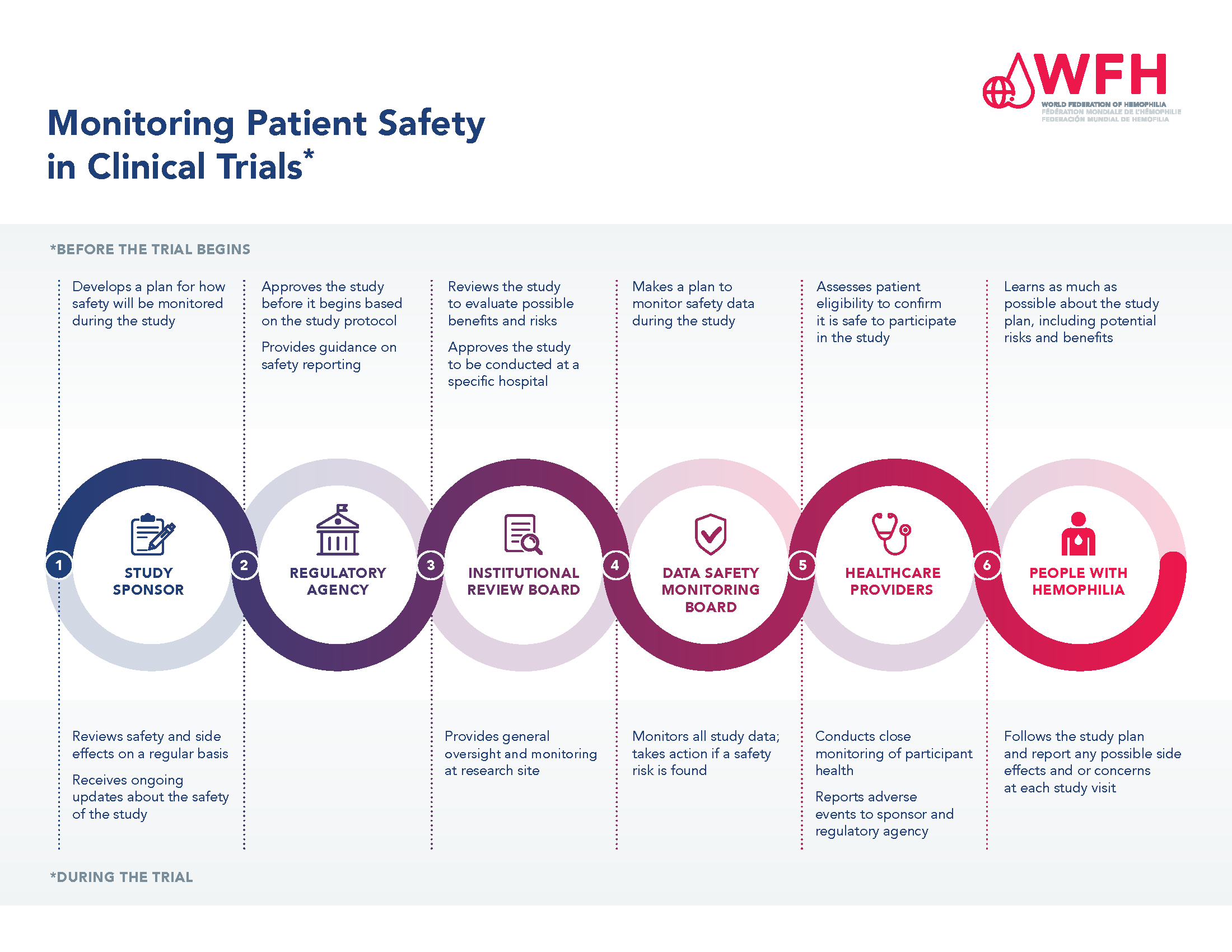
إن ضمان سلامة المرضى له أهمية قصوى أثناء عملية التجارب السريرية. هناك العديد من مستويات الموافقة على الدراسة ومراقبتها لحماية سلامة المشاركين في التجارب السريرية، كما ويوجد نظام لجمع نتائج السلامة والإبلاغ عنها أثناء الدراسة.
بغض النظر عن مرحلة التجربة السريرية، يجب مراجعة كل دراسة والموافقة عليها من قبل وكالة تنظيمية قبل أن يتم تسجيل المرضى للمشاركة. يقوم راعي الدراسة، وغالبًا ما يكون الشركة المصنعة للعلاج قيد الدراسة، بتطوير بروتوكول دراسة يتضمن قسمًا حول كيفية مراقبة سلامة العلاج طوال فترة الدراسة. يجب بعد ذلك الموافقة على بروتوكول الدراسة من قبل وكالة تنظيمية، مثل إدارة الغذاء والدواء الأمريكية (FDA) أو وكالة الأدوية الأوروبية (EMA). وبمجرد الموافقة على الدراسة وتحديد المواقع التي ستتم فيها الدراسة، تقدم المواقع المشاركة بروتوكول الدراسة إلى مجلس المراجعة المؤسسية الذي يستخدمه المستشفى أو مركز علاج الهيموفيليا لغايات استصدار الموافقة، وبمجرد الموافقة على الدراسة، تتم مراقبة سلامة المرضى المشاركين طوال فترة الدراسة من قبل مجلس مراقبة سلامة البيانات، أو راعي الدراسة أو الشركة المصنعة لعلاج الدراسة، وكذلك من قبل المتخصصين في الرعاية الصحية المعنيين
ويلعب الأشخاص المصابين بالهيموفيليا المسجلين في دراسة دورا في الدراسة حيث يقوم المصابين المشاركين بإبلاغ فريق الدراسة في مركز العلاج الخاص بهم عن أي آثار جانبية أو أحداث تتعلق بالسلامة.
يرجى الاطلاع على مراقبة سلامة المرضى في التجارب السريرية لمزيد من المعلومات
يجب على كل مشارك يتطوع للمشاركة في تجربة سريرية التوقيع على نموذج موافقة مستنيرة قبل التسجيل في الدراسة (أو يمكن لأحد الوالدين التوقيع على نموذج موافقة لطفله في حالة المشاركين القصَر). توفر الموافقة المستنيرة معلومات للمرشحين حول التجربة وتشرح المخاطر والفوائد المحتملة المرتبطة بالمشاركة قبل أن يتخذ الشخص قرار الموافقة على المشاركة. تتضمن عملية الحصول على الموافقة المستنيرة مناقشة مع فريق الدراسة قبل التوقيع على النموذج:
بشكل عام، تتضمن عملية الموافقة المستنيرة ما يلي:
فيما يلي قائمة مفصلة من وكالة تنظيمية، في هذا المثال إدارة الغذاء والدواء الأمريكية. كجزء من عملية الموافقة المستنيرة، يجب تقديم هذه المعلومات لكل بحث محتمل قبل التسجيل في تجربة سريرية:
أسئلة يجب طرحها قبل المشاركة في التجارب السريرية
بالنسبة للأشخاص الذين يفكرون في المشاركة في تجربة سريرية، من المهم للغاية معرفة أكبر قدر ممكن عن التجربة السريرية، والمخاطر والفوائد للمشاركين، ومسؤوليات المشاركين، والرعاية المتوقعة، والفريق الذي سيجري التجربة. من المتوقع أن يكون هناك أسئلة، ومن الضروري الإجابة عليها. قد يكون من المفيد تدوين قائمة بالأسئلة التي يجب طرحها قبل الاجتماع بفريق أبحاث التجارب السريرية.
يرجى الاطلاع على الأسئلة التي يجب طرحها قبل المشاركة في التجارب السريرية لمزيد من المعلومات

يلعب أعضاء فريق الرعاية الصحية دورًا حيويًا في التأكد من أن المشاركين المحتملين في الدراسة يفهمون تمامًا معنى أن يكونوا جزءًا من تجربة سريرية.
| مكونات عملية الموافقة المستنيرة | تلبية احتياجات المشاركين المحتملين في التجارب السريرية |
| تزويد المشارك المحتمل في الدراسة بمعلومات كافية للسماح باتخاذ قرار مستنير بشأن المشاركة في التجربة السريرية | هل تم تقديم معلومات شاملة عن التجربة السريرية في شكل ومستوى مناسب، وباللغة الأفضل للفرد؟ |
| التأكد من أن المشارك المحتمل لديه فهم كامل للمعلومات المقدمة | هل هناك عملية قائمة (على سبيل المثال، “إعادة التعليم”) لتأكيد فهم التجربة السريرية، بما في ذلك: دور المريض، وكيف ستعمل التجربة، وتكرار الزيارات الدراسية، وما الذي سيحدث في الزيارات الدراسية، الوقت الذي يجب الالتزام به اجمالا، والمخاطر المحتملة وفوائد المشاركة؟ |
| التأكد من وجود وقت مناسب لطرح الأسئلة ومناقشة بروتوكول البحث مع العائلة والأصدقاء لاتخاذ قرار بشأن المشاركة | هل تم تخصيص الوقت الكافي لتشجيع الأسئلة والإجابة عليها؟ |
| الحصول على الموافقة الطوعية للمشارك المحتمل للمشاركة | هل تم توفير معلومات الاتصال لمتابعة المناقشات أو الأسئلة؟ |
| توفير المعلومات على أساس مستمر مع تقدم التجربة السريرية أو حسب الموقف | هل تم تشجيع المرشحين على مناقشة التجربة السريرية مع أحبائهم / الحصول على مدخلات إضافية قبل اتخاذ قرار بشأن المشاركة؟ |
ملاحظة حول السرية
قد يكون لدى الأفراد الذين يفكرون في المشاركة في تجربة سريرية أسئلة حول معلومات الرعاية الصحية وخصوصيتهم. تشير السرية إلى الحفاظ على الخصوصية بمعلومات ذات صلة بالصحة يمكن تحديدها بشكل فردي للأشخاص الذين يشاركون في التجارب السريرية. يتضمن ذلك سجلات البحث المتعلقة بتحديد الهوية (مثل الاسم) والتشخيص والعلاج أو أي معلومات أخرى متعلقة بالمشارك. في الحالات التي يتم فيها نشر نتائج التجارب السريرية في مجلة محكمة، يتم حذف المعلومات المتعلقة بشخصية المريض، ويتم الحفاظ على الخصوصية في مثل هذه التقارير.
تشارك عدة مجموعات من الأشخاص في عمليات التجارب السريرية، ولديهم جميعًا مسؤوليات وأدوار مختلفة. يلعب المشاركون ومقدمو الرعاية الصحية دورًا مهمًا طوال مدة التجربة السريرية. ومن المهم أن يفهم كل من المشاركين ومقدمي الرعاية الصحية أدوارهم تمامًا.
رجى الاطلاع على الأدوار والمسؤوليات لكل من هذه المجموعات أدناه.
يرجى الاطلاع على أدوار المريض ومقدم الرعاية الصحية في ملف التجارب السريرية لمزيد من المعلومات.

لكل دولة سلطتها التنظيمية الخاصة بها مع اللوائح والقوانين المتعلقة بإجراء التجارب السريرية. تقوم السلطة التنظيمية بمراجعة واعتماد بروتوكولات التجارب السريرية قبل بدء الدراسات وتضمن أن جميع التجارب السريرية تتبع اللوائح الوطنية. تتواصل الوكالة التنظيمية مع الباحثين طوال فترة التجربة السريرية، وتقوم في نهاية التجربة بمراجعة جميع بيانات السلامة والفعالية في برنامج التطوير السريري من أجل تحديد امكانية الموافقة على العلاج / التدخل الجديد وإتاحته للجمهور.
شخص أو شركة أو مؤسسة أو مجموعة أو منظمة تتحمل مسؤولية بدء وإدارة و / أو تمويل تجربة سريرية.
مجموعة من العلماء والأطباء وغير العلماء والمدافعين عن حقوق المرضى الذين يراجعون ويوافقون على الخطة التفصيلية للتجربة السريرية. تهدف مجالس المراجعة المؤسسية إلى حماية الأشخاص الذين يشاركون في التجارب السريرية. في البلدان خارج الولايات المتحدة، تسمى هذه المجموعة لجنة الأخلاقيات.
مجموعة من العلماء المستقلين الذين يراقبون سلامة التجارب السريرية.
الشخص (الأشخاص) المسؤول عن التجارب السريرية. غالبًا ما يكون الباحث الرئيسي أو “الباحث الرئيسي” طبيبًا.
شخص مسؤول عن إجراء التجارب السريرية وفقًا لمبادئ الممارسة المختبرية الجيدة (GLP) وتحت إشراف باحث رئيسي.
أعضاء فريق الرعاية الصحية المشاركين في إجراء تجربة سريرية. يشمل ذلك الأطباء والممرضات ومساعدي الأطباء والصيادلة والعلماء وغيرهم ممن يدعمون المشاركين في التجربة من خلال إجراء الاختبارات والتقييمات / التقييمات في الزيارات الدراسية وجمع البيانات وتنفيذ جميع جوانب بروتوكول التجارب السريرية.
الأفراد الذين يستوفون معايير الأهلية ويشاركون في تجربة سريرية.
تقدمت عيادات العلاج الجيني للهيموفيليا باستخدام أداة الاتحاد العالمي للهيموفيليا للعلاج الجيني لتتبع التجارب السريرية والبقاء على اطلاع بالبحوث الحالية.
مثال 1: مثال على معايير الأهلية في تجربة سريرية للعلاج الجيني (افتراضي)
الجرعة التصاعدية المفردة ذات العلامة المفتوحة من العلاج الجيني XYZ عند البالغين المصابين بالهيموفيليا ب
| معايير الاشتمال | معايير الاستبعاد |
| الذكور ما بين 18-75 سنة | تاريخ عائلي لمثبط بروتين FIX أو دليل مختبري شخصي على تطوير مثبطات لبروتين FIX في أي وقت (> 0.6 وحدة Bethesda في أي اختبار واحد) |
| الهيموفيليا B المثبتة مع 3> نزيف سنويًا يتطلب علاجًا بعامل FIX خارجي أو استخدام الوقاية من FIX بسبب تاريخ نوبات النزيف المتكررة | رد الفعل التحسسي الموثق المسبق لأي منتج من منتجات FIX |
| نشاط البلازما FIX ≤ 2٪ | العلاج الجيني القابل للكشف XYZ تحييد الأجسام المضادة |
|
علامات الالتهاب الكبدي أو التشمع الصريح أو الخفي كما يتضح من واحد أو أكثر مما يلي:
|
مسرد للمصطلحات
| الادارة | في التجارب السريرية، عملية إعطاء علاج (مثل عقار) للمريض. يمكن أن يشير أيضًا إلى الطريقة التي يتم بها تقديم العلاج (على سبيل المثال، عن طريق الفم، في الوريد، عن طريق الاستنشاق، في العضل ، إلخ) ، والجرعة ، أو عدد مرات تقديم العلاج. |
| حدث سلبي | مشكلة طبية، بما في ذلك النتائج المعملية غير الطبيعية التي تحدث أثناء العلاج بدواء أو علاج آخر. قد تكون الأحداث السلبية خفيفة أو معتدلة أو شديدة. في التجربة السريرية، قد يحدث الحدث السلبي بسبب شيء آخر غير العلاج الذي يتم اختباره. |
| ذراع (ذراع الدراسة) | غالبًا ما يتم تقسيم المشاركين في التجارب السريرية إلى مجموعات. يشير مصطلح “الذراع” إلى كل مجموعة أو مجموعة فرعية من المشاركين في تجربة سريرية تتلقى تدخلات محددة (أو لا تتلقى أي تدخل) وفقًا لبروتوكول الدراسة. |
| الخصائص الأساسية | البيانات الديموغرافية والسريرية وغيرها من البيانات التي تم جمعها في بداية تجربة سريرية قبل التدخل والتي يمكن استخدامها للمقارنة بمرور الوقت للبحث عن التغييرات. |
| دراسة عمياء | نوع من الدراسة لا يعرف فيه المشاركون العلاج الذي يتلقونه. في الدراسة العمياء، لا يعرف المرضى / المتطوعون العلاج الذي يتلقونه ولكن يكون فريق البحث على دراية بعلاجهم. في الدراسة مزدوجة التعمية، لا يعرف المرضى ولا الباحثون وظائف العلاج (فقط الصيدلي يعرف). تساعد التعمية على تقليل أي تحيز في نتائج الدراسة. |
| الأبحاث السريرية | البحوث الطبية التي يتم فيها دراسة متطوعين بشريين (بما في ذلك الأشخاص الذين يعانون من حالات صحية معينة) أو بيانات أو عينات من أنسجة من أشخاص لفهم الصحة والمرض بشكل أفضل. هناك نوعان رئيسيان من البحوث أو الدراسات السريرية: التجارب السريرية والدراسات القائمة على الملاحظة. |
| منسق البحوث السريرية (منسق الدراسة) | شخص مسؤول عن إجراء التجارب السريرية وفقًا لمبادئ الممارسة المختبرية الجيدة (GLP) وتحت إشراف باحث رئيسي. |
| تجربة سريرية | نوع من الدراسة البحثية يختبر فيها الباحثون طرقًا جديدة للوقاية من المرض أو اكتشافه أو علاجه. قد يتلقى المشاركون في التجربة السريرية تدخلات محددة وفقًا لبروتوكول مفصل لتلك التجربة السريرية. قد تكون هذه التدخلات منتجات طبية، مثل الأدوية أو الأجهزة أو الإجراءات الجراحية أو تغييرات في السلوك، مثل النظام الغذائي للمشارك. قد تقارن التجارب السريرية نهجًا طبيًا جديدًا بأسلوب قياسي متوفر بالفعل، أو مع دواء وهمي، أو بدون تدخل. التجارب السريرية هي الطريقة الرئيسية التي يستخدمها الباحثون لمعرفة ما إذا كان العلاج الجديد آمنًا وفعالًا لدى الأشخاص. |
| السرية | الحفاظ على خصوصية المعلومات المتعلقة بالصحة التي يمكن من خلالها تحديد هوية الأشخاص المشاركين في التجارب السريرية. يتضمن ذلك سجلات البحث المتعلقة بالهوية (مثل الاسم) أو التشخيص أو العلاج أو أي معلومات أخرى يمكن ربطها بالمشارك. في الحالات التي يتم فيها نشر نتائج التجارب السريرية في مجلة محكمة، يتم إلغاء المعلومات المتعلقة بهوية المريض، ويتم الحفاظ على الخصوصية في مثل هذه التقارير. |
| تضارب المصالح | موقف قد تؤدي فيه الاعتبارات الشخصية أو المالية إلى المساس بالحكم المهني للباحث. |
| مجموعة التحكم | المجموعة الخاضعة للتجربة السريرية التي لا تتلقى العلاج الجديد قيد الدراسة. |
| تجربة سريرية مضبوطة | تجربة سريرية تتضمن مجموعة مقارنة. قد تتلقى مجموعة المقارنة هذه علاجًا وهميًا أو علاجًا آخر أو لا تتلقى أي علاج على الإطلاق. |
| لوحة مراقبة سلامة البيانات | مجموعة من العلماء المستقلين الذين يراقبون سلامة التجارب السريرية. |
| خطة مراقبة سلامة البيانات | خطة مكتوبة تحدد بشكل مسبق وتوثق أنشطة المراقبة المصممة لحماية سلامة المشاركين في تجربة سريرية، وصحة البيانات التي تم جمعها ، وسلامة الدراسة البحثية. |
| تصعيد الجرعة | زيادة تدريجية في جرعة أو قوة العلاج لزيادة التأثير إلى أقصى حد مع تحسين التحمل أو الحفاظ عليه، وتجنب الآثار الجانبية الضارة. |
| دراسة تصعيد الجرعة | نوع من الدراسة يساعد على تحديد أفضل جرعة من دواء أو علاج جديد. عادة ما يتضمن هذا النوع من الدراسة عددًا صغيرًا من الأشخاص، ويتم زيادة جرعة العلاج الجديد قليلاً في كل مرة في مجموعات مختلفة من المشاركين، مع مراقبة الآثار الجانبية الضارة بعناية. |
| تجربة سريرية مزدوجة التعمية | نوع من التجارب السريرية لا يعرف فيه المشاركون في الدراسة ولا الباحثون العلاج الذي يتلقاه المشاركون حتى اكتمال الدراسة. |
| فعالية | قدرة العلاج أو التدخل على إحداث الأثر المفيد المطلوب. |
| أهلية | المتطلبات الأساسية التي يجب تلبيتها للأشخاص للمشاركة في تجربة سريرية. تشمل الأهلية معايير الاشتمال (المطلوبة للمشاركة) ومعايير الاستبعاد (التي تمنع الشخص من المشاركة). |
| التسجيل | عدد المشاركين في دراسة سريرية. |
| معايير الاستبعاد | نوع من معايير الأهلية. وهي أسباب تمنع الشخص من المشاركة في دراسة سريرية. |
| الذراع التجريبية | مجموعة الدراسة من المشاركين الذين تلقوا تدخلًا أو علاجًا يكون محور التجربة السريرية (على عكس ذراع الدواء الوهمي أو المجموعة الضابطة). |
| دراسة موسعة | غالبًا ما يطلق عليها الدراسة المفتوحة أو الدراسة الموسعة طويلة الأجل، وهذا نوع من التجارب السريرية التي تسجل المشاركين في تجربة سريرية سابقة وهي مصممة لجمع بيانات أمان وتحمل إضافية حول علاج أو تدخل جديد محتمل على مدى وقت أطول من فترة التجربة السريرية الأصلية / الرئيسية. |
| ممارسة سريرية جيدة | مجموعة دولية من الإرشادات التي تغطي الطريقة التي يتم فيها تصميم التجارب السريرية وإجرائها وتنفيذها ومراقبتها ومراجعتها وتسجيلها وتحليلها وإعداد التقارير عنها؛ بهدف ضمان حماية المشاركين ، وضمان موثوقية النتائج. |
| متطوع صحي | شخص لا يعاني من حالات صحية خطيرة معروفة ويشارك في البحث السريري. |
| الإنسان موضوع الدراسة | مشارك في دراسة بحثية. |
| معايير الاشتمال | نوع من معايير الأهلية للتجربة السريرية. وهي الشروط التي يجب تلبيتها للسماح للشخص بالمشاركة في تجربة سريرية. |
| موافقة مسبقة | عملية يستخدمها الباحثون لتقديم معلومات شاملة وشرح المخاطر والفوائد المحتملة حول تجربة سريرية قبل أن يقرر الشخص ما إذا كان يريد المشاركة. |
| مجلس المراجعة المؤسسية (IRB) | مجموعة من العلماء والأطباء وغير العلماء والمدافعين عن حقوق المرضى الذين يراجعون ويوافقون على الخطة التفصيلية للتجربة السريرية. تهدف مجالس المراجعة المؤسسية إلى حماية الأشخاص الذين يشاركون في التجارب السريرية. في البلدان خارج الولايات المتحدة، تسمى هذه المجموعة لجنة الاخلاقيات. |
| تحليل مؤقت | تحليل البيانات التي تم جمعها في تجربة سريرية قبل الانتهاء الرسمي للدراسة. |
| تدخل | علاج أو إجراء للوقاية من المرض أو علاجه أو تحسين الصحة يكون محور دراسة سريرية. |
| باحث | شخص يشارك في إجراء تجربة سريرية أو دراسة بحثية. يمكن أن يشمل الباحثون الأطباء والعلماء والممرضات والأخصائيين الاجتماعيين وغيرهم من المتخصصين في الرعاية الصحية. |
| المتابعة طويلة المدى | التقييمات الموسعة التي تستمر في بعض الملاحظات المجدولة للتجربة السريرية بعد فترة المتابعة النشطة. في حالة تجارب العلاج الجيني البشري، قد تكون هذه المدة 5-15 سنة. |
| قناع | مثل “التعمية” في تجربة سريرية. تصمم الدراسات المقنعة لمنع المشاركين وأعضاء فريق البحث من التأثير على نتائج الدراسة. |
| آلية العمل | مصطلح يستخدم لوصف كيف يحدث دواء أو علاج تأثيرًا في الجسم. |
| تجربة متعددة المراكز | تجربة سريرية تجرى في أكثر من مؤسسة طبية. |
| دراسة مبنية على المشاهدة | في الدراسة القائمة على الملاحظة، يقيس الباحثون نتائج صحية معينة في مجموعات من المشاركين وفقًا لخطة بحث أو بروتوكول. لا يتم تعيين المشاركين لتدخلات محددة من قبل الباحث (كما هو الحال في تجربة سريرية) ولكنهم قد يتلقون علاجًا يعد بالفعل جزءًا من رعايتهم الطبية الروتينية. |
| تجربة سريرية مفتوحة التسمية | نوع من التجارب السريرية يعرف فيه المشاركون والباحثون العلاج الذي يُعطى للمشاركين. |
| قياس النتيجة | المقياس المختار لتقييم تأثير العلاج أو التدخل في تجربة سريرية. |
| الدوائية | نشاط الأدوية في الجسم على مدى فترة زمنية، بما في ذلك طريقة امتصاص الأدوية وتوزيعها في الجسم وتوطينها في الأنسجة وإزالتها. |
| مرحلة | تجرى التجارب السريرية على مراحل تدريجية. التجارب في كل مرحلة لها غرض محدد، وتساعد الباحثين على الإجابة على أسئلة مختلفة. |
| العلاج الوهمي | علاج يبدو وكأنه علاج جديد يتم اختباره في تجربة سريرية ولكن لا يحتوي على أي مكونات نشطة. |
| تجربة وهمية |
دراسة سريرية تتم فيها مقارنة العلاج موضع الاخبار بمجموعة تحكم تتلقى علاجًا وهميًا (علاج يشبه العلاج التجريبي ولكن لا يحتوي على أي مكونات نشطة). |
| نقطة النهاية الأولية | في بروتوكول الدراسة السريرية، يعتبر قياس النتيجة المخطط له الأكثر أهمية لتقييم تأثير التدخل / العلاج. |
| الباحث الرئيسي | الشخص (الأشخاص) المسؤول عن التجارب السريرية. غالبًا ما يكون الباحث الرئيسي أو “الباحث الرئيسي” طبيبًا. |
| بروتوكول | الخطة التفصيلية التي تتبعها التجربة السريرية، بما في ذلك الهدف من الدراسة، من هو المؤهل للمشاركة، وعدد المشاركين المطلوبين، والحماية من مخاطر المشاركين في الدراسة، وتفاصيل حول الاختبارات، والإجراءات، والعلاجات، والمدة المتوقعة للتجربة، وما هي المعلومات التي سيتم جمعها. |
| العشوائية | العملية التي يتم من خلالها تخصيص العلاجات للمشاركين في تجربة سريرية عن طريق الصدفة وليس عن طريق الاختيار. لا يختار الباحث ولا المشارك العلاج الذي سيتلقاه مشارك معين. |
| حالة التوظيف | حالة تسجيل عدد المشاركين في تجربة سريرية. سيكون لكل تجربة سريرية عدد تقديري من المشاركين في بداية الدراسة. تُستخدم مجموعة متنوعة من المصطلحات لوصف حالة التوظيف ، مثل “لم يتم التوظيف بعد” [لم تبدأ الدراسة بعد في توظيف المشاركين] ، “توظيف” [تقوم الدراسة حاليًا بتوظيف المشاركين] ، “التسجيل عن طريق الدعوة” [الدراسة تختار المشاركين فيها من مجموعة من الأشخاص ، يقررها الباحثون مقدمًا] ، “نشطون ، غير موظفين” [الدراسة جارية ، والمشاركين يتلقون تدخلاً أو يخضعون للفحص ، لكن المشاركين المحتملين لم يتم توظيفهم أو تسجيلهم بعد] ، إلخ. |
| التسجيل | نظام يستخدم طرق الدراسة القائمة على الملاحظة لجمع البيانات حول العلاج والنتائج ورفاهية المشاركين المحددين بمرض أو حالة أو أعراض معينة. |
| نقطة نهاية ثانوية | في بروتوكول الدراسة السريرية ، هي قياس (أو مقاييس) للنتائج المخطط لها و التي ليست بنفس أهمية مقياس النتيجة الأولية لتقييم تأثير التدخل أو العلاج ، ولكن لا تزال موضع اهتمام. |
| حدث سلبي خطير | يعتبر الحدث السلبي أو التفاعل الضار المشتبه به “خطيرًا” إذا كان من وجهة نظر الباحث يؤدي إلى أي من النتائج التالية: الوفاة ، أو تهديد للحياة ، أو دخول المستشفى أو إطالة فترة الاستشفاء الحالية ، أو عدم قدرة كبيرة على القدرة على القيام بوظائف الحياة الطبيعية ، أو تشوه / عيب خلقي. |
| تجربة سريرية أحادية التعمية | تجربة سريرية لا يعرف فيها المشاركون في الدراسة الدواء أو العلاج الذي يتلقونه. |
| ممول | شخص أو شركة أو مؤسسة أو مجموعة أو منظمة تتحمل مسؤولية بدء وإدارة و / أو تمويل تجربة سريرية. |
| المعايرة | المعايرة عملية تعديل جرعة العلاج الطبي لتحقيق أقصى فائدة (فعالية) دون آثار ضارة. |
| التحمل | الدرجة التي يمكن للمشارك في الدراسة تحمل الآثار الجانبية للعلاج. وهي تختلف عن “سلامة” العلاج، والتي تشير إلى الخطر الطبي على الشخص الذي يتلقى مثل هذا العلاج. |
يشكر الاتحاد العالمي للهيموفيليا الرعاة على دعمهم المالي السخي الذي سمح لنا بتطوير الموارد التعليمية للمرضى ومقدمي الرعاية الصحية على مستوى العالم.
FDA. Clinical Trials: What Patients Need to Know
NIH. NIH Clinical Research Trials and You
NIH U.S. National Library of Medicine. About Studies
U.S. National Library of Medicine. Clinical Trials
NIH. National Library of Medicine. Glossary of common site terms