Français / Español / 简体中文 / русский / العربية / 日本語
© 2026 World Federation of Hemophilia
ВФГ играет важную роль в проведении информационно-просветительской работы для нашего сообщества по вопросам процесса клинических испытаний. На этой странице вы найдете информацию обо всех аспектах клинических испытаний, включая следующее:
Инструмент ВФГ – канал информации о клинических испытаниях генной терапии гемофилии
Узнайте больше о любом появляющемся препарате для генной терапии и о статусе его разработки.
Фазы клинического испытания
Узнайте о различных фазах клинических испытаний, включая продолжительность исследования и критерии перехода к следующей фазе испытания.
Обеспечение безопасности участников
Ознакомьтесь с различными процессами, обеспечивающими постоянный контроль безопасности участников.
Участие в клиническом испытании
Узнайте больше о различных вопросах, которые необходимо задать перед участием в клиническом испытании.
Прокрутите вниз, чтобы узнать больше о клинических испытаниях.
В клинических исследованиях обычно участвуют добровольцы, участники или задействуют собранные у людей образцы (крови или других тканей) с целью расширения медицинских знаний. Существует два основных вида клинических исследований: клинические испытания (также называемые интервенционными исследованиями) и наблюдательные исследования.
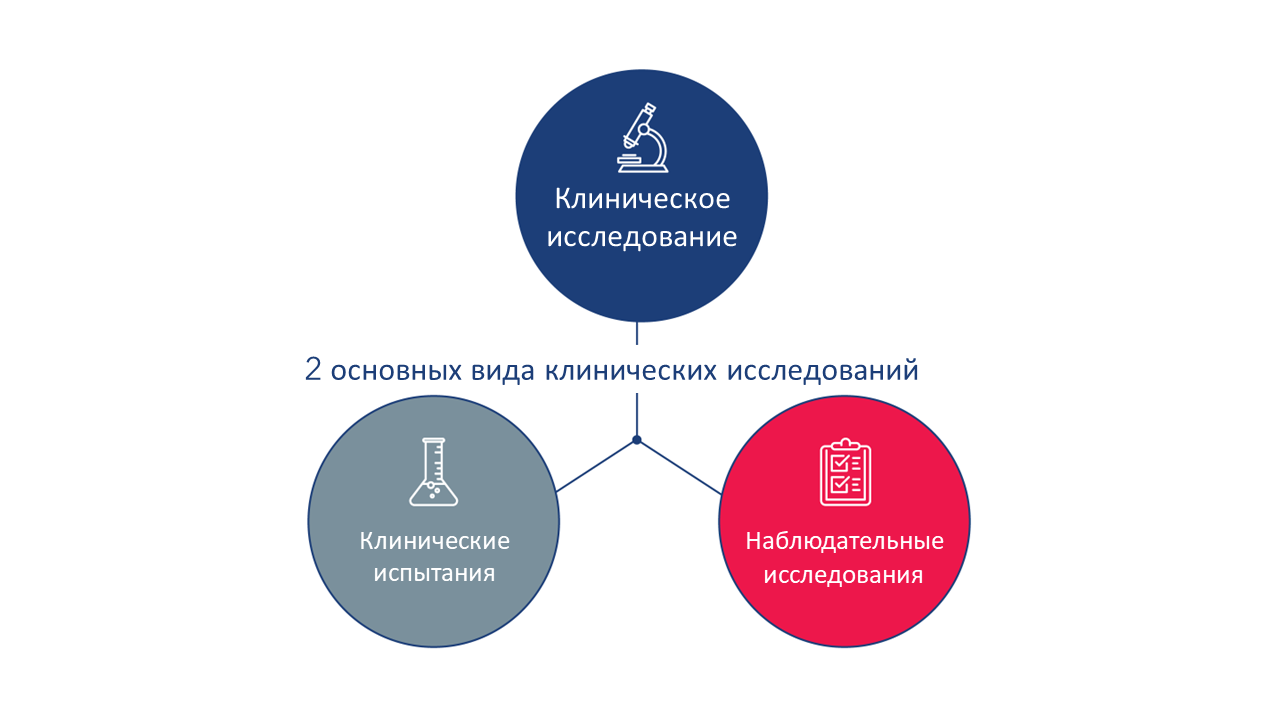
Клиническое испытание — это вид исследования, в ходе которого специалисты тестируют новые способы профилактики, выявления или лечения заболеваний. Участники клинического испытания подвергаются конкретным вмешательствам в соответствии с подробным протоколом соответствующего клинического испытания. Такими вмешательствами могут быть медицинские продукты, такие как лекарства или устройства, хирургические процедуры или изменения в поведении, например, диета участника.
В рамках клинических испытаний новый метод лечения может сравниваться с уже существующим стандартным методом, с плацебо или отсутствием вмешательства. Клинические испытания являются основным методом, который используют исследователи, чтобы выяснить, является ли новое лечение безопасным и эффективным. Чтобы лекарственное средство стало препаратом, который могут назначать врачи, оно должно пройти ряд клинических испытаний, известных как фаза 1, фаза 2 и фаза 3. После фазы 3 данные клинических испытаний представляются в регулирующий орган, который затем определяет, следует ли разрешить применение препарата.
Существуют различные виды клинических испытаний:
При описании клинических испытаний часто используются следующие термины:
Наблюдательное исследование — это вид исследования, в котором исследователи наблюдают за эффектами вмешательства в группе участников, не производя вмешательства самостоятельно. Исследователи не назначают участникам конкретные вмешательства, как в клинических испытаниях, но участники могут получать лечение, которое уже является частью их обычного медицинского обслуживания. Затем исследователи могут оценить связи между вмешательством и клиническими исходами среди людей, которые подвергаются вмешательству в рамках стандартного лечения. Такие результаты могут повлечь за собой дальнейшее исследование в рамках клинического испытания. Существует несколько различных видов наблюдательных исследований. Регистр пациентов — это один из видов наблюдательных исследований.
Регистр пациентов — это организованная система, в которой используются методы наблюдательного исследования для сбора данных о методах лечения, клинических результатах и благополучии населения, определяемом конкретным заболеванием, состоянием или экспозицией.
Для сообщества гемофилии важны два регистра пациентов:
1. Всемирный регистр коагулопатий
Всемирный реестр коагулопатий (ВРК (WBDR)) — это интернет-система ввода данных, которая обеспечивает платформу для сети центров лечения гемофилии по всему миру, позволяющую организовать сбор единообразных и стандартизированных данных о пациентах, а также направлять клиническую практику. С информированного согласия пациента в ВРК хранятся обезличенные данные о его заболевании, такие как тип и степень тяжести гемофилии, симптомы, лечение и клинические результаты.
Медицинские работники, участвующие в ВРК, могут использовать ВРК для отслеживания и мониторинга прогресса своего пациента и руководства его клиническим лечением. Эти обезличенные и конфиденциальные данные также могут быть использованы для того, чтобы помочь исследователям ответить на важные вопросы о неравенстве в уровне медицинского обслуживания во всем мире и содействовать продвижению инициатив в области адвокации и политики здравоохранения.
Нажмите здесь для просмотра страницы ВРК.
2. Регистр генной терапии Всемирной федерации гемофилии
Благодаря международному сотрудничеству ВФГ разработала всемирный регистр пациентов, получающих генную терапию, — регистр генной терапии ВФГ (РГТ(GTR)). Цель РГТ — создать надёжную, соответствующую научным критериям базу данных, доступную для всех медицинских учреждений, занимающихся лечением людей с гемофилией, которые получают генную терапию, в любой точке мира. Данные, собранные с помощью РГТ ВФГ, будут использоваться для оценки долгосрочных результатов по безопасности и эффективности генной терапии у лиц с гемофилией.
Нажмите здесь для получения информации об РГТ ВФГ.
Следующая таблица может быть полезна для понимания того, чем клинические исследования отличаются от оказания медицинской помощи.
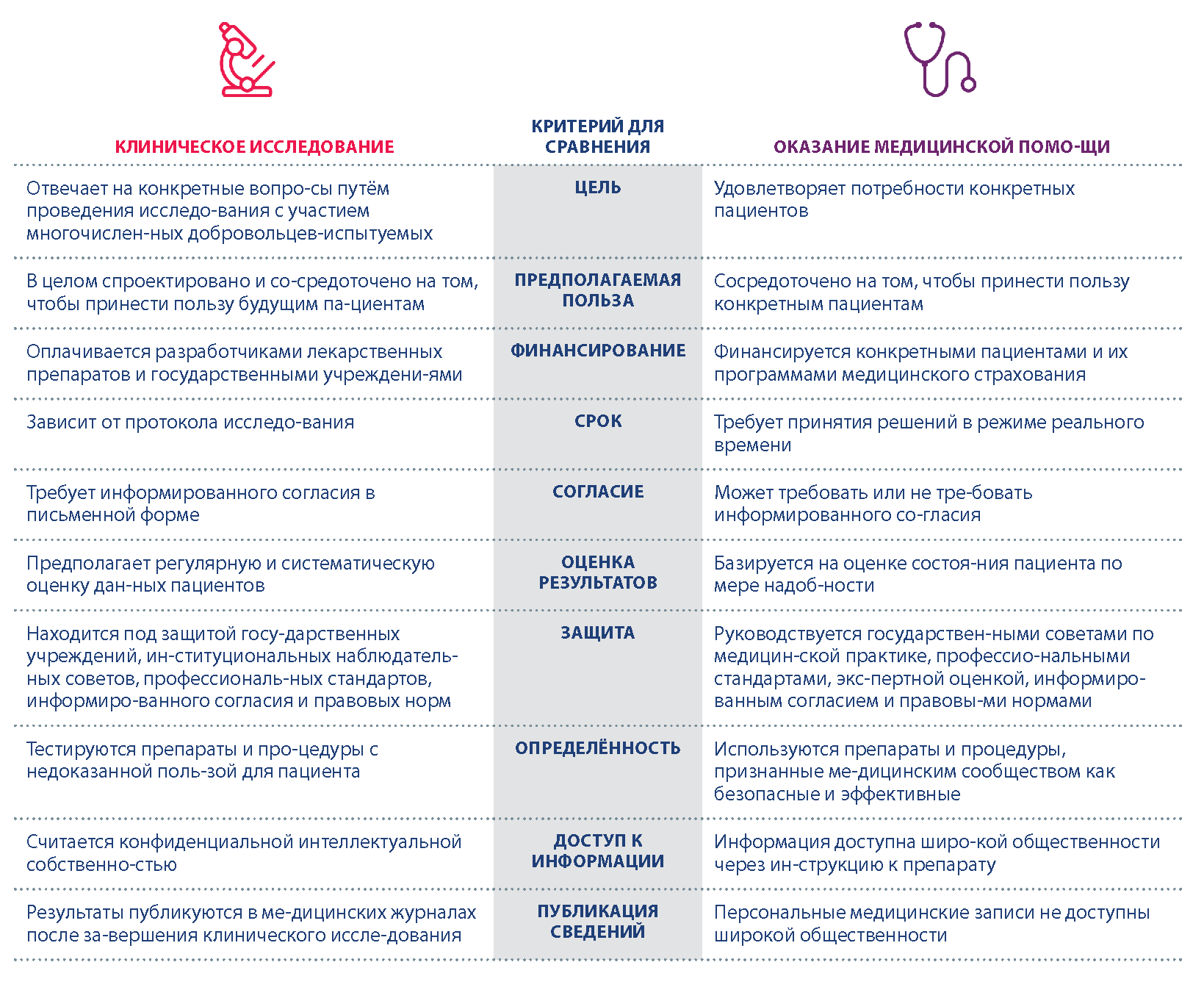
Клинические испытания разрабатываются и проводятся для поиска наилучших способов диагностики, лечения и профилактики заболеваний или состояний здоровья. Прежде чем медицинское вмешательство или лечение будет одобрено регулирующим органом (таким, как Европейское агентство по лекарственным средствам — EMA или Управление по контролю за продуктами и лекарствами США — FDA) для использования пациентами, оно должно быть протестировано в ходе клинических испытаний, чтобы убедиться в его безопасности и эффективности. Некоторые распространенные причины для проведения клинических испытаний включают в себя:
Так, например, в настоящее время проводится множество клинических испытаний на различных фазах разработки, в ходе которых оценивается безопасность и эффективность генной терапии для людей с гемофилией.
Для того, чтобы лекарственный препарат стал средством, которое могут назначать врачи, он должен сначала пройти через ряд фаз клинических испытаний, а затем получить оценку и одобрение регулирующего органа. Каждая фаза клинических испытаний имеет свою цель, и фазы проходят в порядке от фазы 1 до фазы 4.
Фаза 1.
Это — первый раз, когда новое исследуемое лекарственное средство испытывается на людях. Цель клинических испытаний фазы 1 — оценить безопасность и побочные эффекты, связанные с лечением. Они часто проводятся на небольшой группе здоровых добровольцев. Однако при редких заболеваниях, таких как гемофилия, испытания фазы 1 обычно проводятся на людях с гемофилией. Клинические испытания фазы 1 обычно длятся несколько месяцев, и примерно 70% лекарственных средств, протестированных в рамках фазы 1, переходят в следующую фазу. Клиническая разработка не выходит за рамки фазы 1 для остальных 30% препаратов, которые не показали свою безопасность в фазе 1.
В клинических испытаниях 1-й фазы генной терапии гемофилии принимают участие от 10 до 30 человек с гемофилией.
Фаза 2.
Цель клинических испытаний фазы 2 — продолжить проверку безопасности и побочных эффектов, связанных с лечением, а также протестировать эффективность и определить наиболее эффективные дозировки. Испытания фазы 2 обычно проводятся на большем количестве участников, чем испытания фазы 1, и включают людей, страдающих заболеванием. В некоторых ситуациях испытания фазы 1 и фазы 2 объединяются и называются фазой 1/2. Клинические испытания фазы 2 обычно длятся от нескольких месяцев до 2 лет. По оценкам, 30% лекарственных средств, прошедших испытания в рамках фазы 2, переходят в следующую фазу. Клинические разработки не выходят за рамки фазы 2, если не доказана эффективность лечения или имеются проблемы с безопасностью.
В клинических испытаниях 2-й фазы генной терапии гемофилии участвуют от 10 до 50 человек с гемофилией. Это число меньше, чем при других заболеваниях, поскольку гемофилия – редкое заболевание. Клинические испытания I и 2 фазы часто объединяются для редких заболеваний, таких как гемофилия. Объединяя фазы испытаний, производители лекарственных средств надеются ускорить сроки разработки новых препаратов.
Фаза 3.
Цель клинических испытаний фазы 3 — подтвердить эффективность лечения, провести мониторинг побочных эффектов и сравнить новый препарат со стандартными или аналогичными средствами. Испытания фазы 3, иногда называемые «опорными испытаниями», проводятся на большом количестве людей с заболеванием и в разных местах (в масштабе страны или на международном уровне, в зависимости от исследования). Клинические испытания фазы 3 иногда рандомизированы и зачастую проводятся в двойном слепом режиме. Клинические испытания фазы 3 обычно длятся от 1 до 4 лет и являются последним этапом перед подачей заявки в регулирующий орган для получения разрешения. Примерно 25% исследований фазы 3 переходят в фазу 4.
Данные опорного исследования фазы 3, а иногда и данные клинических исследований фаз 1 и 2 представляются на рассмотрение в регулирующий орган. Он, в свою очередь, проводит независимый анализ безопасности и эффективности терапии и принимает решение о том, разрешена ли терапия для использования пациентами или нет.
Клинические испытания 3-й фазы генной терапии гемофилии охватывают 50-150 человек с гемофилией и проводятся в исследовательских центрах по всему миру.
Фаза 4.
Фаза 4, иногда называемая постмаркетинговыми исследованиями, проводится после того, как новая терапия получила одобрение регулирующих органов и стала доступно для пациентов. Эти исследования позволяют ученым собрать дополнительную информацию о долгосрочных рисках (включая редкие побочные эффекты) и преимуществах терапии, а также об оптимальном применении в реальных условиях.
Дополнительную информацию см. в PDF-документе «Как новые методы лечения тестируются в ходе клинических испытаний».

Каждое клиническое испытание имеет подробный, всеобъемлющий план проведения исследования, называемый протоколом. Протокол клинического испытания разрабатывается для того, чтобы ответить на конкретные вопросы исследования и защитить здоровье участников исследования. Перед началом клинического испытания протокол рассматривается и утверждается регулирующим органом. Информация, содержащаяся в протоколе клинического испытания, включает в себя нижеследующее:
Программа клинической разработки нового метода терапии или вмешательства определяет, является ли новая терапия эффективной и безопасной. В протоколе клинического испытания первичный конечный критерий — это запланированный показатель результата, который является наиболее важным для оценки вмешательства или способа лечения. В зависимости от фазы клинического испытания первичный конечный критерий может быть направлен на безопасность, например, связанные с лечением нежелательные явления и/или изменения по сравнению с исходным уровнем в клинических лабораторных тестах; или же критерий может быть сфокусирован на эффективности, например, годовой частоте кровотечений или уровне фактора.
Примеры конечных критериев безопасности и эффективности в клинических испытаниях при гемофилии (включая испытания генной терапии):
| Конечные критерии безопасности | Конечные критерии эффективности |
|---|---|
|
|
Решение об участии в клинических испытаниях необходимо тщательно обдумать и обсудить со своим врачом и членами семьи. С помощью врача вы должны взвесить преимущества и риски участия, а также необходимую для участия затрату времени.
Очень важно понимать потенциальные преимущества и риски участия в клиническом испытании.
| Потенциальные преимущества | Потенциальные риски |
|---|---|
| Вы можете получить доступ к новому методу лечения до его появления и стать одним из первых, кто воспользуется его преимуществами | Вы можете столкнуться с нежелательными побочными эффектами нового лечения |
| Вы будете пользоваться поддержкой команды специалистов по лечению гемофилии, которые будут внимательно следить за вашим здоровьем | Новый метод терапии может не сработать для вас, или же вы можете получить плацебо, если это плацебо-контролируемое исследование |
| У вас будет возможность играть активную роль в сохранении вашего здоровья и улучшить собственную стратегию лечения гемофилии. | Изучаемый новый метод терапии может оказаться не лучше, чем ваш уже имеющийся стандарт лечения. |
| Вы можете помочь будущим пациентам с диагнозом гемофилия, внеся свой вклад в разработку потенциального метода терапии. | Испытание может отнять у вас больше времени, чем ваше обычное лечение; возможно, вам придется чаще посещать врачей и сдавать анализы |
Потенциальным участникам клинического испытания необходимо помнить, что его целью является изучение нового метода лечения или вмешательства.
Пациенты приглашаются к участию в клинических испытаниях через свою команду по оказанию медицинской помощи, исходя из критериев соответствия требованиям данного исследования. Под критериями соответствия требованиям понимаются основные требования, которые должны быть выполнены для участия в клиническом испытании. Эти критерии помогают обеспечить безопасность участников и гарантировать, что на конкретные исследовательские вопросы, прорабатываемые в рамках клинического испытания, можно будет получить точные ответы.
Каждое исследование имеет как критерии включения, так и критерии исключения.
Для клинических испытаний гемофилии общими факторами, определяющими соответствие требованиям, являются степень тяжести и тип гемофилии, возраст, ингибиторный статус, а также история профилактики. Каждое клиническое испытание уникально, и критерии соответствия требованиям варьируются от исследования к исследованию. Многие клинические испытания начинаются сначала на взрослых, перед тем, как изучать новый метод лечения на детях. По этой причине очень часто возраст указывается в качестве критерия включения.
Хотите узнать больше о критериях включения?
Люди с гемофилией, заинтересованные в участии в клиническом исследовании, проходят «процесс отбора», в ходе которого исследовательская группа определяет, соответствует ли данный человек критериям отбора для участия в исследовании. Процесс отбора будет включать изучение истории болезни и текущего медицинского состояния ЛСГ, а также обсуждение ролей и обязанностей участников, потенциальных рисков и преимуществ участия.
Важно понимать, что не у всех, кто заинтересован в клиническом исследовании, будет возможность принять в нём участие. Это может произойти потому, что какой-то аспект истории болезни человека не соответствует критериям включения в исследование (например, в исследование могут быть включены только ЛСГ определённого возраста). Кроме того, в каждом клиническом исследовании будет указано предполагаемое количество участников для запланированного набора; когда клиническое исследование наберёт необходимое количество людей, оно прекратит приём дополнительных участников исследования.
Рассмотрим пример (вымышленный) критериев приемлемости для клинических испытаний по гемофилии: Пример 1 Генная терапия при гемофилии
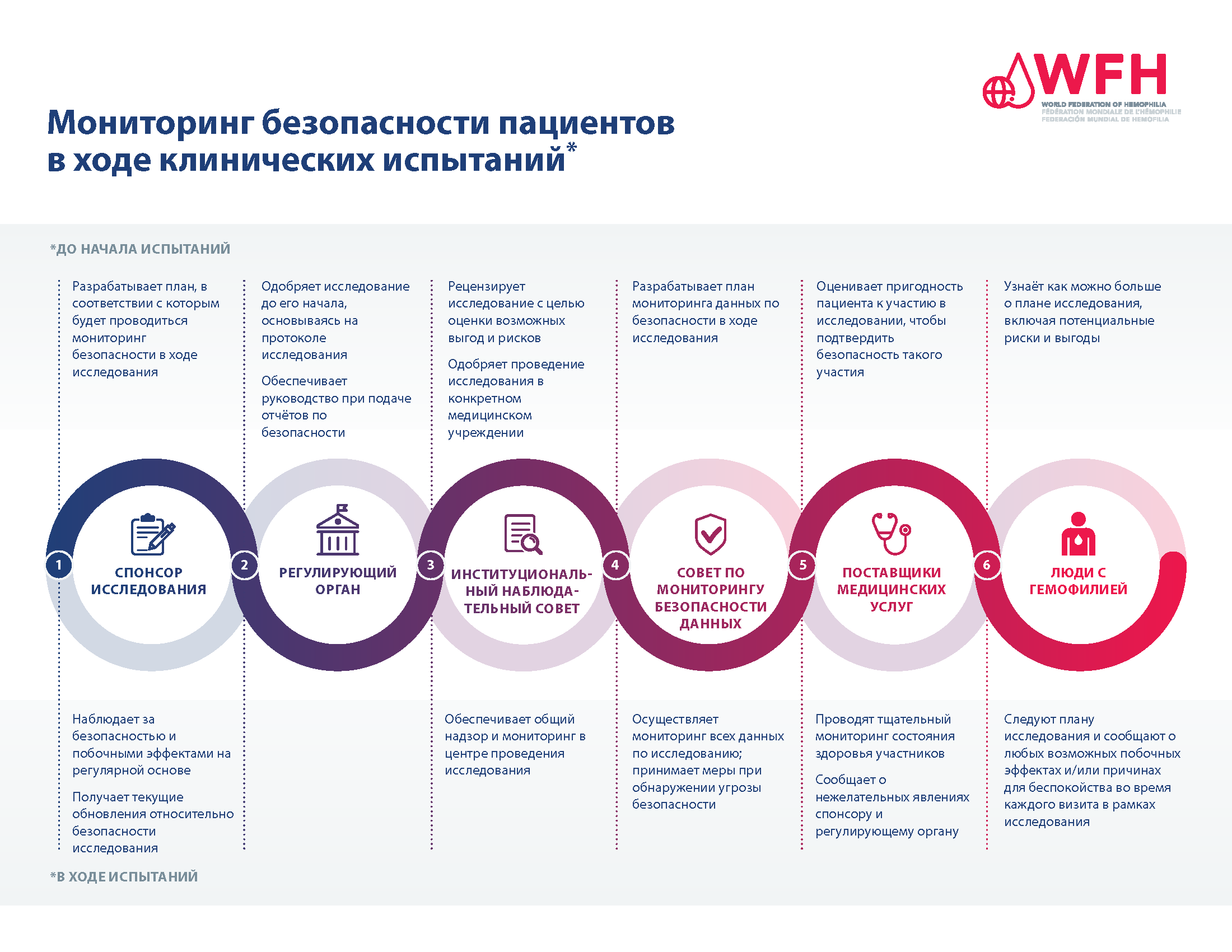
Обеспечение безопасности пациентов имеет первостепенное значение в процессе клинических исследований. Для обеспечения безопасности участников клинических испытаний существует множество уровней утверждения и мониторинга исследований, а также система сбора и предоставления отчётности о результатах в области безопасности по ходу исследования.
Независимо от этапа клинического испытания каждое исследование должно быть рассмотрено и одобрено регулирующим органом, прежде чем в него будут вовлечены пациенты. Спонсор исследования, часто производитель исследуемого метода лечения, разрабатывает протокол исследования, который включает раздел о том, как в ходе исследования будет контролироваться безопасность терапии. Затем протокол исследования должен быть утверждён регулирующим органом, таким как Управление по контролю за продуктами и лекарствами США (FDA) или Европейское агентство по лекарственным средствам (EMA). После утверждения исследования и определения мест проведения исследования участвующие в нем учреждения должны запросить и получить одобрение протокола исследования в Экспертном совете больницы или центра лечения гемофилии, где оно будет проводиться.
После утверждения исследования безопасность участвующих в нем пациентов контролируется на протяжении всего исследования Независимым комитетом по мониторингу данных, спонсором или компанией-производителем исследуемого метода лечения, а также участвующими в исследовании медицинскими работниками. ЛСГ, участвующие в исследовании, также играют определенную роль. ЛСГ, участвующие в исследованиях, должны информировать исследовательскую группу в своём лечебном центре, если у них возникают какие-либо побочные эффекты или события, связанные с безопасностью.
Дополнительную информацию см. в PDF-документе «Мониторинг безопасности пациентов в ходе клинических исспытаний».
Каждый участник, желающий принять участие в клиническом испытании, должен до включения в исследование подписать форму информированного согласия (либо родитель может подписать форму согласия за своего ребёнка в случае участия несовершеннолетних). Информированное согласие предоставляет потенциальным участникам информацию об испытании и объясняет потенциальные риски и преимущества, связанные с участием в исследовании, до того, как человек примет решение об участии. Процесс получения информированного согласия включает в себя обсуждение с исследовательской группой до подписания формы.
В целом процесс получения информированного согласия включает в себя нижеследующее:
Ниже приводится подробный список, составленный регуляторным органом, в данном примере — FDA (Управлением по контролю за продуктами и лекарствами США). Как часть процесса получения информированного согласия, эта информация должна быть предоставлена каждому потенциальному субъекту исследования перед его включением в клиническое испытание:
Для людей, рассматривающих возможность участия в клиническом испытании, чрезвычайно важно как можно больше узнать об испытании, о рисках и преимуществах для участников, об обязанностях участников, ожидаемом медицинском обслуживании и команде, которая будет проводить испытание. Ожидается, что у вас возникнут вопросы, и принципиально важно, чтобы на них были даны ответы. Возможно, перед встречей с исследовательской группой, проводящей клиническое испытание, будет полезно составить список вопросов, которые следует задать.
Для дополнительной информации см. PDF-документ «Вопросы, которые следует задать перед участием в клиническом испытании».

Члены медицинской бригады играют важную роль в обеспечении того, чтобы потенциальные участники исследования полностью понимали, что будет означать участие в клиническом испытании.
| Компоненты процесса получения информированного согласия | Удовлетворение потребностей потенциальных участников клинических испытаний |
|---|---|
|
|
|
|
|
|
|
|
|
|
У людей, рассматривающих возможность участия в клиническом испытании, могут возникнуть вопросы о медицинской информации и конфиденциальности. Конфиденциальность означает сохранение в тайне индивидуально идентифицируемой информации о состоянии здоровья лиц, участвующих в клинических испытаниях. Она включает в себя записи исследований, относящиеся к идентификации (например, имя), диагнозы, прогнозы, сведения о лечении или любую другую информацию, которую можно связать с участником. В случаях, когда результаты клинического испытания публикуются в рецензируемом журнале, информация, относящаяся к пациенту, обезличивается, и в таких отчётах персональные данные сохраняются в тайне.
В процесс клинических испытаний вовлекаются многие различные группы людей, которые имеют различные обязанности и роли. Участники и поставщики медицинских услуг играют важную роль на протяжении всего процесса клинического испытания. Важно, чтобы как участники, так и поставщики медицинских услуг полностью понимали свою роль.
Ниже приведены роли и обязанности каждой из этих групп.
Для получения дополнительной информации см. PDF-документ «Роли пациента и поставщика медицинских услуг в ходе клинических испытаний».

В каждой стране есть свой регулирующий орган со своими правилами или законами относительно проведения клинических испытаний. Регулирующий орган рассматривает и утверждает протоколы клинических испытаний до начала исследований и следит за тем, чтобы все клинические испытания соответствовали государственным законодательным нормам. Регулирующий орган взаимодействует с исследователями на протяжении всего процесса клинических испытаний и в конечном итоге анализирует все данные о безопасности и эффективности программы клинических разработок, чтобы определить, следует ли утвердить новый препарат/вмешательство и сделать его общедоступным.
Частное лицо, компания, учреждение, группа или организация, которая берёт на себя ответственность за инициирование, управление и/или финансирование клинического испытания.
Группа учёных, врачей, сотрудников, не связанных с наукой, а также специалистов по адвокации, которая рассматривает и утверждает подробный план клинического испытания. ЭСО призван защищать людей, которые принимают участие в клиническом испытании. В странах помимо США эта группа называется Этическим комитетом.
Группа независимых учёных, которые следят за безопасностью и достоверностью клинического исследования.
Лицо (лица), ответственное (ые) за клиническое испытание. Руководитель испытания, или «РИ», часто является врачом.
Лицо, ответственное за проведение клинических испытаний в соответствии с принципами надлежащей лабораторной практики (НЛП) и работающее под управлением руководителя клинического испытания.
Члены медицинской бригады, участвующие в проведении клинического испытания. В неё входят врачи, медсёстры, фельдшеры, фармацевты, учёные и другие лица, которые оказывают поддержку участникам на протяжении всего процесса клинического испытания, проводят тесты, оценку/анализы во время посещений, собирают данные и выполняют все части протокола клинического испытания.
Лица, отвечающие критериям соответствия требованиям и участвующие в клиническом испытании.
Следите за ходом клинических испытаний генной терапии гемофилии с помощью Канала информации ВФГ о генной терапии гемофилии, чтобы отслеживать информацию о клинических испытаниях и быть в курсе текущих исследований.
Открытое клиническое исследование генной терапии XYZ с однократными нарастающими дозами у взрослых с гемофилией B
| Критерии включения | Критерии исключения |
|---|---|
|
|
|
|
|
|
|
|
© 2026 World Federation of Hemophilia